A cellular hierarchy framework for understanding heterogeneity and predicting drug response in acute myeloid leukemia
Résumé
Le but est de comprendre comment l’hétérogénéité est liée à la réponse à la thérapie. Pour cela, ils ont déterminé la hiérarchie des cellules leucémique à partir de transcriptomes (bulk) de 1000 patients par le biais de déconvolution en utilisant des profiles références de cellules de type souches leucémiques, progénitrices et matures décrites par des analyses de single-cells. La composition hiérarchique de la leucémie est associée à des propriétés fonctionnelles, génomiques et cliniques et convergent dans 4 classes représentant Primitive, Mature, GMP 1 et Intermédiaire. Les variations dans la composition hiérarchique entre les axes Primitives et GMP ou Primitives et Matures sont associées à la réponse à la chimiothérapie ou à la réponse au traitements ciblés respectivement. 7 gènes biomarqueurs ont été identifiés dérivant de la comparaison Primitive vs Mature et sont associés à la réponse pour 105 médicaments expérimentaux. La composition hiérarchique cellulaire se révèle être une nouvelle approche pour mieux comprendre la biologie de la maladie et faire progresser la médecine de précision dans la LAM.
Introduction
La LAM est caractérisée par une hétérogénéité inter et intra patient. Celle-ci rend les nouvelles thérapies aussi hétérogènes et il n’existe pas de moyens fiables pour sélectionner la meilleure thérapie pour chaque patient.
Deux approches sont actuellement utilisées pour caractériser l’hétérogénéité de la LAM. Le modèle génomique avec les modifications cytogénétiques et les mutations. Cependant, les mêmes modifications génétiques peuvent montrer des différences fonctionnelles et même en ciblant ces mutations avec des inhibiteurs spécifiques, ces modèles ont une valeur prédictive très faible sur des thérapies ciblant certains processus biologiques ou voies de signalisation spécifiques.
La deuxième approches est liées au caractère souche des cellules leucémiques (LSC). Ces LSC sont impliqués dans la rechute et l’expression de leurs gènes est devenue un marqueur prédisant le dévenir des patients après la chimiothérapie.
Malheureusement, ces modèles ne sont pas suffisant et une méthode intégrant ces modèles est nécessaire.
La composition hiérarchique cellulaire de chaque patient semblerait refléter les conséquences fonctionnelles de mutations spécifiques dans le maintien de la leucémie. Cependant, la relation entre cette composition hiérarchique et la réponse aux thérapies reste inconnue.
Dans cette étude, les compositions hiérarchiques de plus de 1000 patients ont été caractérisées via la déconvolution de leur transcriptomes en utilisant des profiles de cellules souches, progénitrices et matures provenant de single-cell.
Résultats
L’hétérogénéité des cellules souches leucémique et progénitrices.
Ils ont analysé les profiles single-cell de 13.653 cellules à partir de données de 12 patients LAM au diagnostic avec un focus sur les population de cellules souches primitives et de cellules progénitrices de blastes (Maintenant appelés LSPCs2).
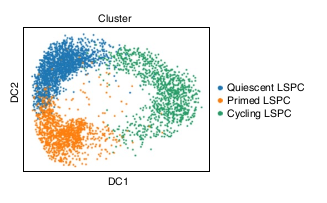
Via des analyses single-cell, ils ont identifié 3 populations dans les LSPCs :
- La population Quiescent LSPC (Faible variation d’expression)
- La population Primed LSPCs (Amorçage du cycle cellulaire)
- La population Cycling LSPCs (Cell en “cycle”)
Ajout des 3 populations de LSPCs au autres types cellulaires identifiés par van Galen et al 3 (GMP1-like blasts, ProMono-like blasts, Mono-like blastes et cDC-like blasts4)
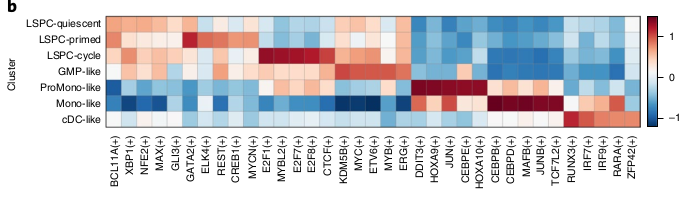
Déconvolution des populations cellulaires constitutives de la LAM
Ils ont ensuite voulu chercher à comprendre comment ces populations de cellules LAM définies et les hiérarchies dans lesquelles elles sont organisées sont liées aux propriétés fonctionnelles, biologiques et cliniques de la LAM. Pour cela, ils ont analysé des données de transcriptomes qu’ils ont déconvolu pour inférer leur composition hiérarchique leucémique. Ils ont notamment utilisé CIBERSORTx en utilisant 7 single-cell de cellules leucémiques (Quiescent, Primed, Cycling LSPCs, GMP, ProMono, Mono et cDC -like) et 7 single-cell de cellules immunes non leucémiques (NK, Naive T, CD8+ T, B, Plasma, Monocytes et cDCs) comme référence.
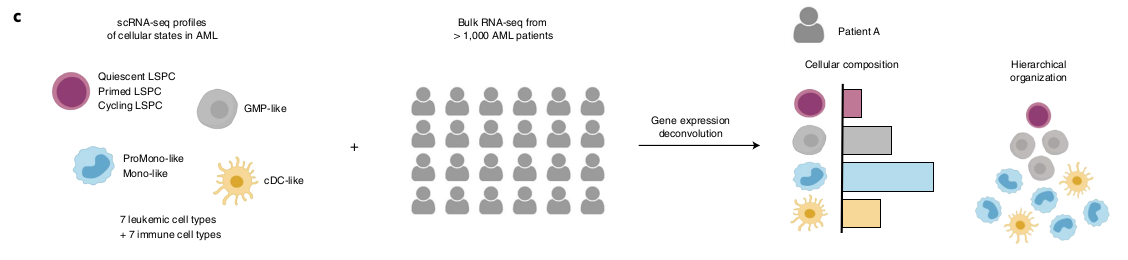
Les LSCs fonctionnels s’associent avec l’abondance des LSPCs quiescents.
Ils ont tout d’abord voulu déterminer si un des nouveau type de LSPC est associé avec l’activité LSC5. Ils ont donc performé 111 RNAseq de LAM dont l’activité LSC avait été mesuré par xenogreffe et ont appliqué la méthode de déconvolution.
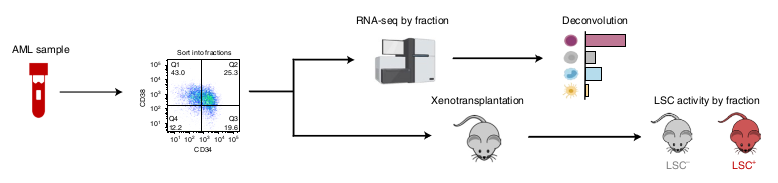
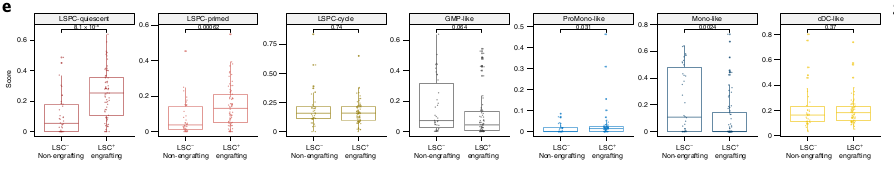
Les RNAseq ayant une LSC élevée (avec greffe réussie) sont enrichis en Quiescent LSPCs et Primed LSPCs et inversement, ceux avec une LSC faible sont enrichis en Mono-like blasts.
A partir de ces résultats, ils ont voulu prédire l’activité LSC à partir de cette déconvolution et elle semble être plus performante que l’immuno-phénotypage.
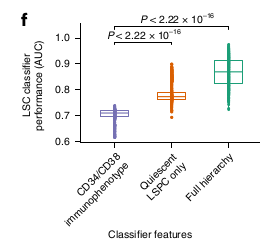
Les Quiescent LSPCs sont associés avec la fréquence de LSC+.
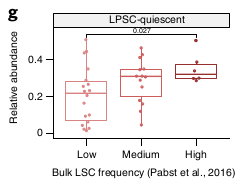
Ces résultats établissent un lien entre le transcriptomes des LSPCs et la fonction de LSCs et suggère que cette activité de LSC peut être inféré par déconvolution des données de patients.
La composition hiérarchique est associée à la génomique des LAM
Ils ont ensuite clusterisé les données RNAseq de patients provenant de TCGA, BEATaml et Leucegene en fonction de la composition en type cellulaire prédit avec la méthode de déconvolution. Ce clustering a formé 4 sous-types distincts :
- Primitive (enrichi en LSPCs)
- Mature (enrichi en mature Mono-like et cDC-like)
- GMP (enrichi en GMP-like)
- Intermédiaire (distribution à l’équilibre)
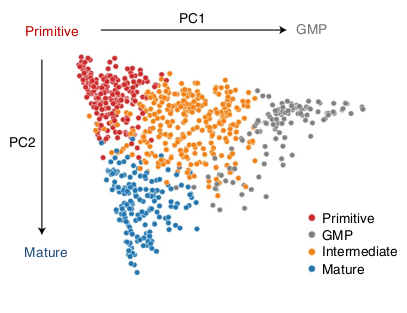
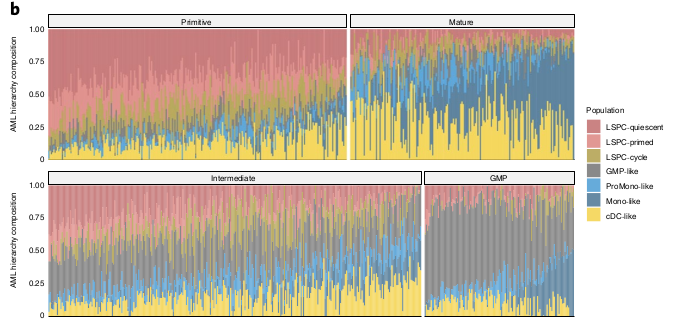
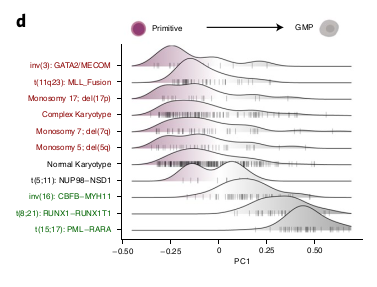
La composition était corrélée à différents paramètres cliniques comme l’âge, le WBC et la classe FAB. Ils se sont focus sur les évènements cytogénétiques et mutations.
En regardant le PC1, ils ont pu séparer différents types d’évènements cytogénétiques :
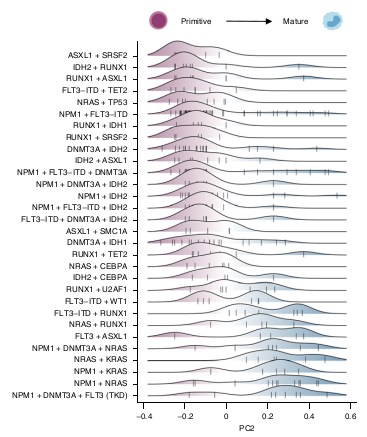
Et des évènements de mutations à partir du PC2.
L’analyse de l’axe Primitif versus GMP capture le prognosis du patient
La composition prédite est lié à la survie
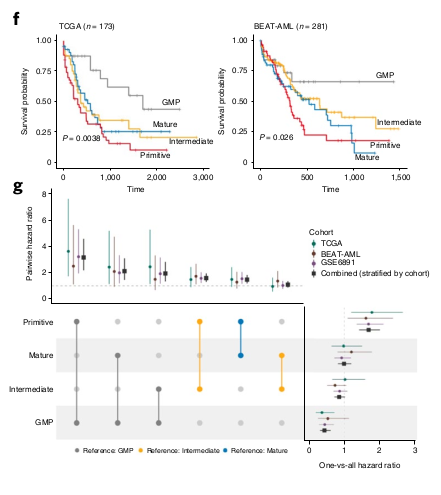
L’abondance en Quiescent LPSC et Cycling LSPC sont des signes de mauvais prognostique alors que l’abondance en GMP-like est favorable. “Strikingly, the composite survival score that included all three of these populations was highly anti-correlated with PC1” La PC2 ne semble pas corrélée. Cela peut être dû au PC1 qui capture une partie du score prognostique.
La composition hiérarchique change du diagnostique à la rechute
Pour répondre à cette question, ils ont analysé des données à la rechute et comparé avec les données au diag.
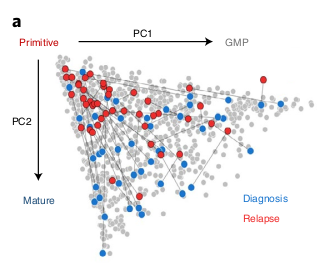
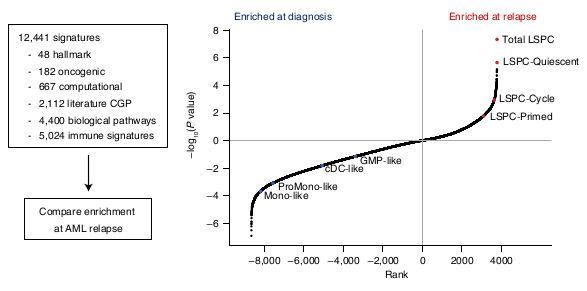
Les données à la rechute semblent plus proches du statut primitif.
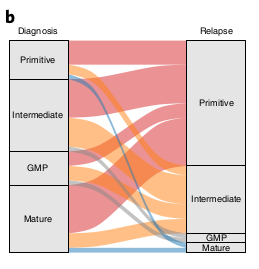
Avec un enrichissement particulier dans les Quiescent LSPCs.
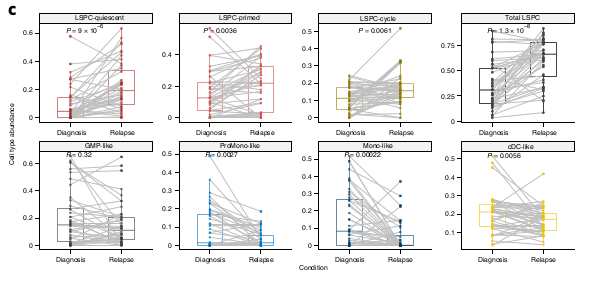
Vérification sur des données single Cells
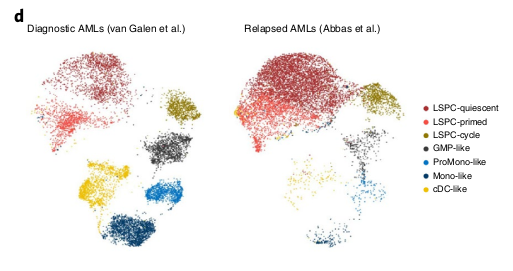
Analyse de 12.441 signatures et comparaisons avec les types cellulaires
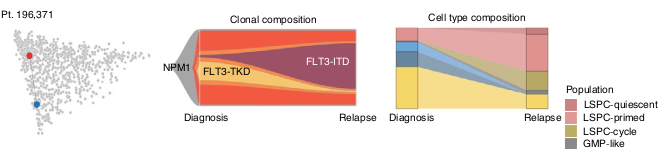
Une certaine contextualisation des pattern d’évolution clonale est possible.
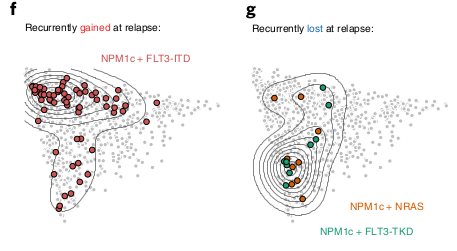
Les NPM1 mutant sont acquiert régulièrement la mutation FLT3-ITD générant des blastes plus primitifs. Les pertes de mutations NRAS et FLT3-TKD semblent générer des matures cells.
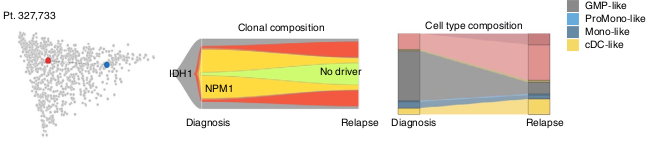
Des shifts dans la composition hiérarchique suivent des pattern d’évolution clonale.
D’autres semblent liés à des modes d’évolution non-génétiques.
L’axe Primitive versus Mature capture la sensitivité aux traitements ex vivo.
Ils se sont ensuite demandé si les échantillons de LAM ayant des compositions cellulaires différentes variaient dans leur vulnérabilité aux nouvelles thérapies expérimentales. Pour cela, ils ont utilisé des données d’ex vivo drug sensitivité provenant de 2 datasets.
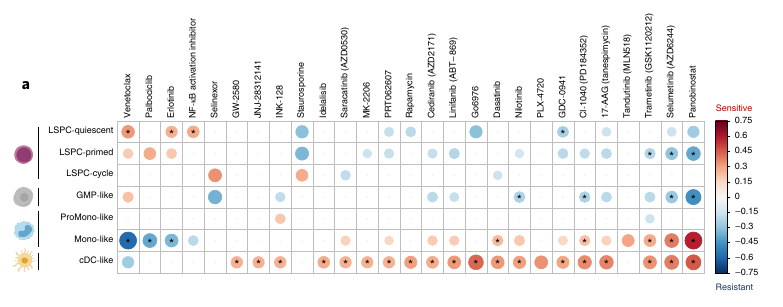
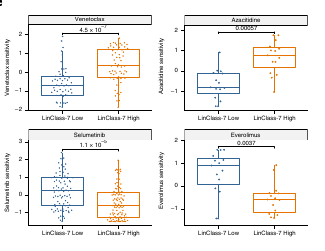
Les réponses semblent suivre l’axe de la composante 2 PC2 et l’axe Primitive-Mature.
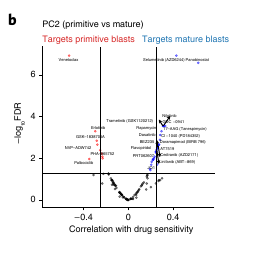
Pour vérifier cette hypothèse, ils ont clusterisé les patients selon leur profile de réponse au traitement et en comparant leur expression génique, ils ont montré un enrichissement pour les programmes primitif de HSC pour le premier cluster et pour des programmes matures myéloides pour le second.
Cela confirme l’importance de l’axe Mature-Primitive dans la réponse aux traitements.
Le score de l’expression génique basée sur la hiérarchie prédit la réponse aux traitements
Ils ont ensuite modifié le score LSC17 composé de 17 gènes en utilisant un algorithme de réduction de variable appelé LASSO et en y incorporant l’axe PC2 pour définir un score de classification de lignée à partir de 7 (applé LinClass-7).
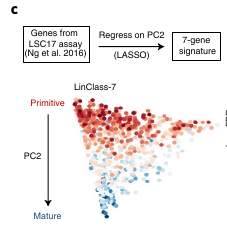
Ce score semble corréler avec la réponse à différents traitements.
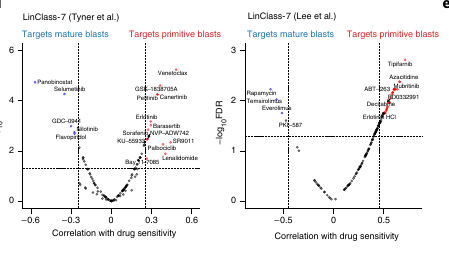
Le score LCS17 n’était pas capable de cette corrélation.
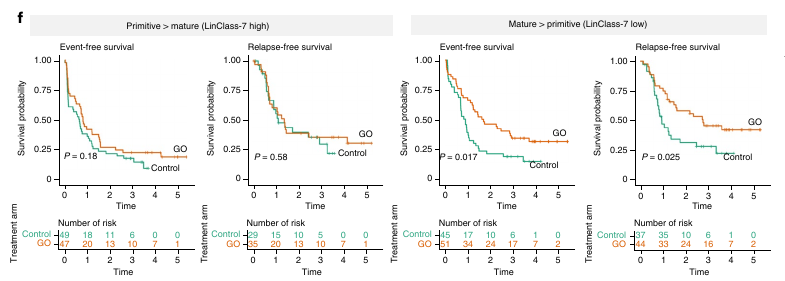
Afin de tester cette hypothèse, ils ont repris des données d’un essai clinique pour le traitement à petite dose de gemtuzumab ozogamicin et ont associé à chaque patient un score LinClass-7. Dans leur étude, le traitement GO avait un effet sur l’event-free survival et sur le relapse free survival mais pas sur la survie globale.
Le score LinClass-7 sépare bien les bons des mauvais répondeurs et le traitement GO sur les patients avec un LinClass-7 high ne semble pas avoir d’effet ni sur le EFS ni sur le RFS. Cependant, les patients LinClass-7 low, eux, ont une EFS et RFS plus élevée suite à un traitement GO.
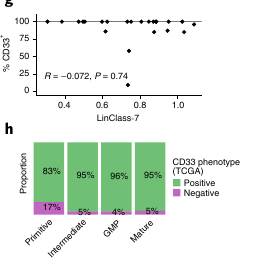
La cible de GO ne semble pas être liée, ni au score LinClass-7 ni à leur composition hiérarchique.
Ces résultats montrent que le score LinClass-7 peut prédire de l’efficacité de traitement comme le GO.
Un cadre hiérarchique pour la LAM afin de guider les études précliniques sur les médicaments
Pour comprendre comment les traitement médicamenteux affectent la composition cellulaire, ils ont analysé des données RNAseq avant et après traitement.
Ils ont projeté ces rnaseq en UMAP celon les changements qu’ont entraîné le traitement.
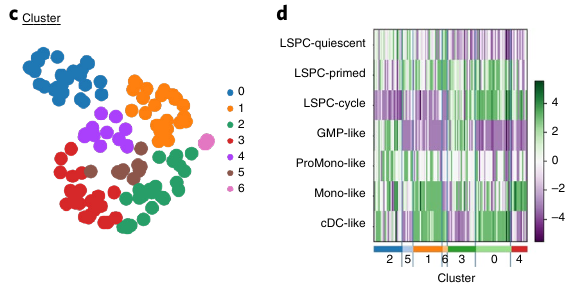
Par exemple, ATRA induit une differentiation prédominante des GMP-like. Le DHODH lui réduit la population de LSPC-quiescent.
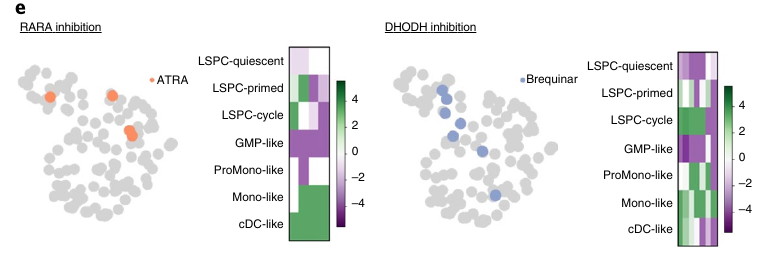
Le traitement Selinexor, ciblant la protéine de transport nucléaire XPO1 semble cibler préférentiellement les LSPC-like cells et cette population semble elle même la cible du traitement.
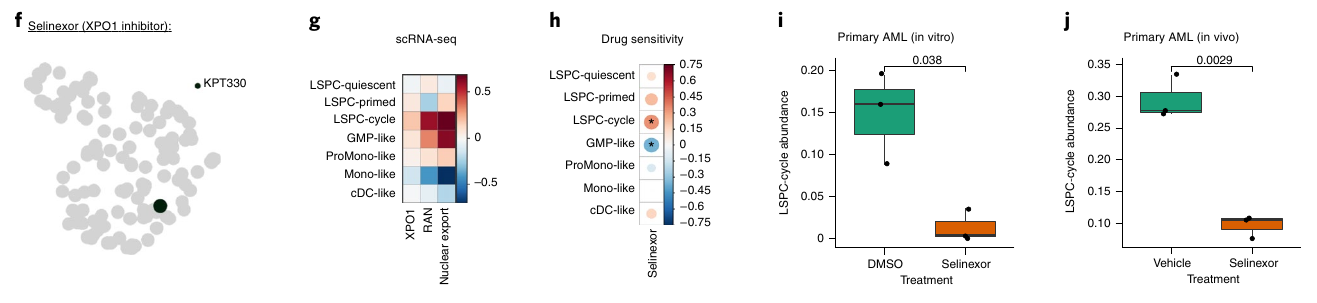
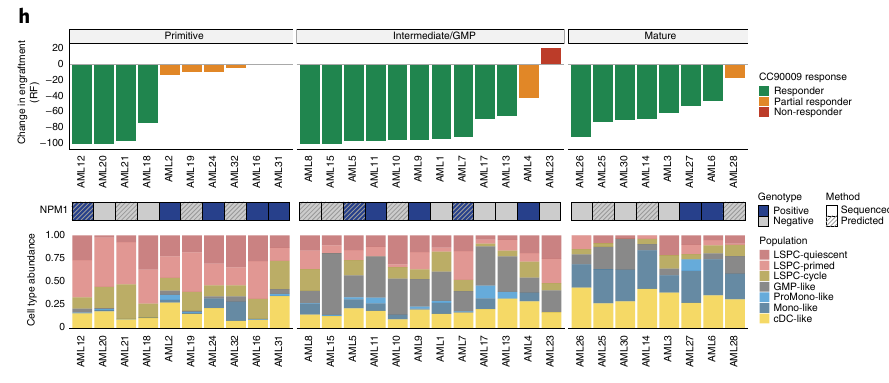
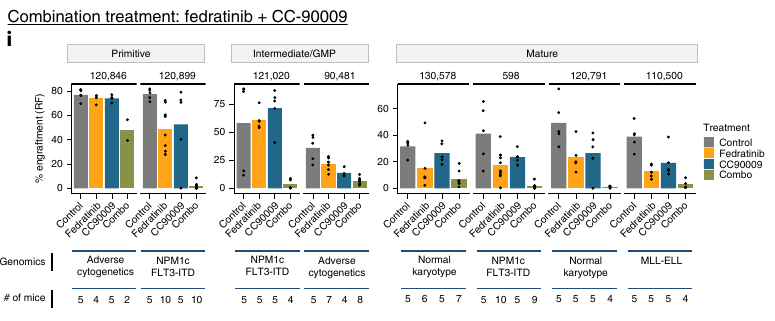
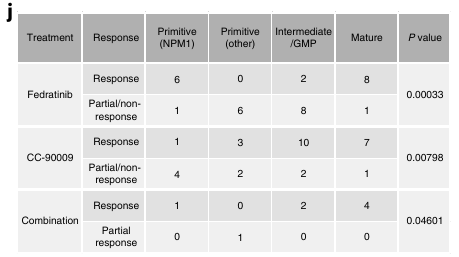
Ils se sont ensuite focus sur deux traitements, une JAK2 inhibiteur et un agent immunomodulateur CC-90009 qui induit la dégradation de GSPT1. Ils ont comparé les bon répondeur aux répondeurs partiels et mauvais répondeurs.

JAK2 semble plus expirmé chez les Mono-like et cDC-like et le traitement semble affecter de manière plus importante ces mêmes types cellulaire.
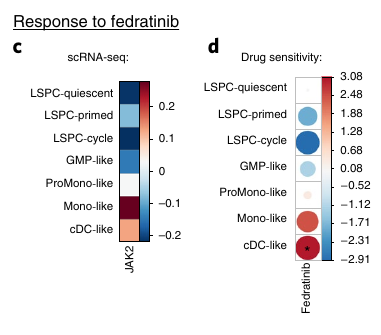
La composition hiérarchique mature semble montrer une meilleure réponse au traitement.
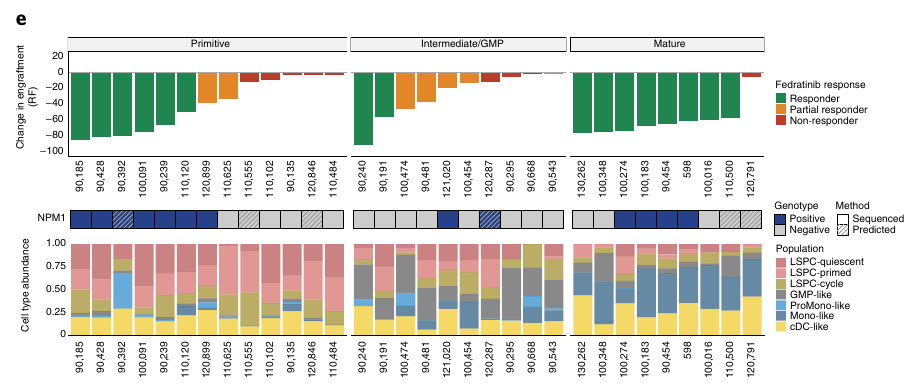
Les patients présentant une proportion importante de blastes matures répondent mieux.
Pour le traitement contre la GSPT1, elle est exprimée plus fortement dans les LSPC-cycle et GMP-like. Ces dernières sont aussi enrichies dans les bons répondeurs et les LSPC-quiescent enrichies dans les mauvais répondeurs.
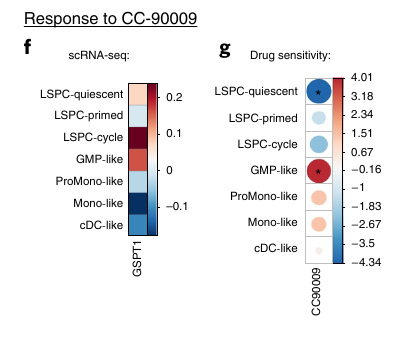
Au niveau des sous-groupes, les Intermédiaires, GMP-like et Matures semblent mieux répondre et les Primitives ont un taux de réponse faible.